Ngày 31/12, Cục Quản lý dược, Bộ Y tế công bố hai thông báo đình chỉ lưu hành, thu hồi và tiêu hủy trên toàn quốc hai sản phẩm dưỡng da của thương hiệu mỹ phẩm Obagi do phát hiện có chứa hoạt chất hydroquinone.
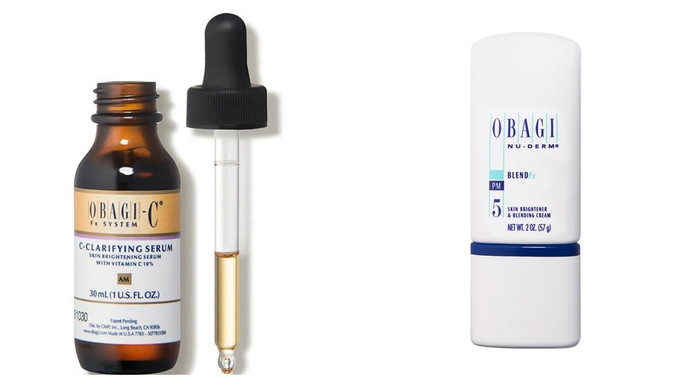
Theo thông báo, Cục Quản lý Dược cho biết, lô sản phẩm Obagi-C Fx CClarifying Serum - Hộp 1 chai 30 ml. Trên nhãn ghi Số lô: 81262; NSX: 17/3/2023; HSD: 17/3/2026; do Công ty Swiss-American CDMO LLC, địa chỉ: 2055 Luna Road # 126, Carrollton, TX 75006, USA sản xuất; Tổ chức chịu trách nhiệm đưa sản phẩm ra thị trường bởi Công ty TNHH MTV thương mại xuất nhập khẩu Obagi Việt Nam, địa chỉ 12-12A Núi Thành, Phường 13, Quận Tân Bình, TP.HCM
Lý do thu hồi: Mẫu kiểm nghiệm không đạt tiêu chuẩn chất lượng (có phát hiện hydroquinone với hàm lượng 0,027%).
Cùng ngày 30/12, Cục Quản lý Dược cũng thông báo đình chỉ lưu hành, thu hồi trên toàn quốc lô sản phẩm Obagi Nu-Derm Blend Fx - Chai 57g. Trên nhãn ghi Số lô: 88011; HSD: 12/9/2026; do Công ty G.S. Cosmeceutical USA, Inc, địa chỉ: 131 Pullman Street, Livermore, CA 94551, USA sản xuất; Tổ chức chịu trách nhiệm đưa sản phẩm ra thị trường bởi Công ty TNHH một thành viên thương mại xuất nhập khẩu Obagi Việt Nam, địa chỉ: 12-12A Núi Thành, Phường 13, Quận Tân Bình, TP.HCM
Lý do thu hồi: Mẫu kiểm nghiệm không đạt tiêu chuẩn chất lượng (có phát hiện hydroquinone với hàm lượng 0,019%).
Được biết, Theo Phiếu công bố đã được Cục Quản lý Dược cấp cho các sản phẩm Obagi-C Fx CClarifying Serum và Obagi Nu-Derm Blend Fx, trong thành phần công thức sản phẩm kê khai trên Phiếu công bố không có thành phần hydroquinone, nhưng có thành phần có arbutin. Theo các tài liệu khoa học về Arbutin (Tên khoa học (INCI name): 4- Hydroxyphenyl-β-D-glucopyranoside; tên khác: Beta arbutin; số CAS 497-76-7) khi hòa tan trong nước có thể bị thủy phân, tạo ra một lượng rất nhỏ hydroquinone.
Cũng trong nội dung quyết định, Cục Quản lý Dược đề nghị Sở Y tế các tỉnh, thành phố trực thuộc Trung ương, thông báo cho các cơ sở kinh doanh, sử dụng mỹ phẩm trên địa bàn ngừng ngay việc kinh doanh, sử dụng lô sản phẩm Obagi-C Fx C-Clarifying Serum - Hộp 1 chai 30 ml và sản phẩm Obagi Nu-Derm Blend Fx - Chai 57g trả lại cơ sở cung ứng sản phẩm;
Tiến hành thu hồi lô và tiêu hủy lô sản phẩm vi phạm nêu trên; kiểm tra, giám sát các đơn vị thực hiện thông báo này; xử lý các đơn vị vi phạm theo quy định hiện hành.
Yêu cầu Công ty TNHH MTV thương mại xuất nhập khẩu Obagi Việt Nam phải gửi thông báo thu hồi tới những nơi phân phối, sử dụng lô sản phẩm ObagiC Fx C-Clarifying Serum - Hộp 1 chai 30 ml và lô sản phẩm Obagi Nu-Derm Blend Fx - Chai 57g nêu trên; tiếp nhận sản phẩm trả lại từ các cơ sở kinh doanh và tiến hành thu hồi, tiêu hủy toàn bộ lô sản phẩm không đáp ứng quy định.
Gửi báo cáo thu hồi và tiêu hủy lô sản phẩm Obagi-C Fx C-Clarifying Serum - Hộp 1 chai 30 ml và lô sản phẩm Obagi Nu-Derm Blend Fx - Chai 57g nêu trên về Cục Quản lý Dược trước ngày 10/1/2025.
Sở Y tế TP.HCM giám sát Công ty TNHH MTV thương mại xuất nhập khẩu Obagi Việt Nam trong việc thực hiện thu hồi và tiêu hủy các lô sản phẩm không đáp ứng quy định.
Kiểm tra Công ty TNHH MTV thương mại xuất nhập khẩu Obagi Việt Nam trong việc chấp hành các quy định của pháp luật về quản lý mỹ phẩm trong hoạt động sản xuất, kinh doanh mỹ phẩm; xử lý, xử phạt vi phạm theo quy định hiện hành.