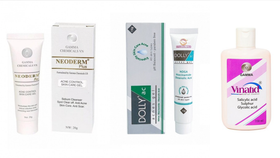
Cục Quản lý Dược (Bộ Y tế) vừa thông báo đình chỉ lưu hành, thu hồi trên toàn quốc lô sản phẩm Gel Promed hộp 1 tuýp 30g, số tiếp nhận phiếu công bố 52/22/CBMP-HY, số lô sản xuất 010124, ngày sản xuất 8/1/2024, hạn sử dụng 8/1/2027.
Được biết, sản phẩm trên do Công ty cổ phần dược phẩm công nghệ cao Starmed (Thôn Xuân Đào, xã Xuân Dục, thị xã Mỹ Hào, tỉnh Hưng Yên) sản xuất. Tổ chức chịu trách nhiệm đưa sản phẩm ra thị trường là Công ty cổ phần tập đoàn dược phẩm Starmed (C12, TT6 khu đô thị Văn Quán – Yên Phúc, phường Phúc La, quận Hà Đông, thành phố Hà Nội).
Theo giới thiệu của Starmed, Gel Promed là sản phẩm có công dụng sát khuẩn, giúp bảo vệ da đặc biệt trong những trường hợp da dễ bị nhiễm khuẩn ở những vết thương nhỏ trên bề mặt da hoặc da có nguy cơ bội nhiễm vi khuẩn trong một số bệnh gây ra do virus. Cùng với đó là đẩy nhanh quá trình tái tạo tế bào da mới, giúp vết thương mau lành, tránh thâm da và ngừa sẹo.
Mẫu mỹ phẩm trên do Trung tâm kiểm nghiệm thuốc, mỹ phẩm, thực phẩm (Sở Y tế thành phố Hà Nội) lấy mẫu tại Nhà thuốc An Khánh (số nhà 3, ngõ 51, phố Trần Điền, phường Định Công, quận Hoàng Mai, thành phố Hà Nội) để kiểm tra chất lượng.
Kết quả kiểm nghiệm cho thấy mẫu thử chứa Methylparaben không có trong thành phần công thức sản phẩm đã được cấp số tiếp nhận phiếu công bố sản phẩm mỹ phẩm. Hàm lượng Phenoxyethanol trong mẫu thử là 1,08%, vượt quá giới hạn cho phép là 1,0% theo quy định tại tham chiếu số 29, phụ lục VI (Annexes VI) Hiệp định mỹ phẩm ASEAN.
Đồng thời, nhãn và hướng dẫn sử dụng có các nội dung không phù hợp với phiếu công bố và Thông tư số 06/2011/TT-BYT. Cụ thể, nhãn và hướng dẫn sử dụng có chứa cụm từ không phù hợp như “ngừa sẹo”, “tái tạo tế bào da mới, mau lành vết thương”, “Đối tượng sử dụng: Các bệnh ngoài da do nhiễm virus tay chân miệng, hepes, thủy đậu (trái dạ, phỏng dạ), zona, sởi; vết thương nhỏ ở bề mặt da, vết cắt, vết rách da nhỏ ít chảy máu, phồng rộp, chầy xước; vết bỏng nhẹ đến vừa; mụn trứng cá; viêm da, viêm lỗ chân lông, lở loét, mụn nước; vết côn trùng cắn, muỗi đốt”.
Do vậy, Cục Quản lý Dược đề nghị Sở Y tế các tỉnh, thành phố trực thuộc Trung ương thông báo cho các cơ sở kinh doanh, sử dụng mỹ phẩm trên địa bàn ngừng ngay việc kinh doanh, sử dụng lô sản phẩm Gel Promed – Hộp 1 tuýp 30g nêu trên và trả lại cơ sở cung ứng sản phẩm.
Bên cạnh đó, tiến hành thu hồi và tiêu hủy lô sản phẩm vi phạm, kiểm tra và giám sát các đơn vị thực hiện thông báo, xử lý các đơn vị vi phạm theo quy định hiện hành.
Công ty cổ phần tập đoàn dược phẩm Starmed, Công ty cổ phần dược phẩm công nghệ cao Starmed phải gửi thông báo thu hồi tới những nơi phân phối, sử dụng lô sản phẩm nêu trên. Tiếp nhận sản phẩm trả lại từ các cơ sở kinh doanh và tiến hành thu hồi, tiêu hủy lô sản phẩm không đáp ứng quy định.
Đồng thời, gửi báo cáo thu hồi lô sản phẩm về Cục Quản lý Dược trước ngày 29/8/2025. Rà soát việc sản xuất và ghi nhãn nhãn, hướng dẫn sử dụng đối với các lô khác đã sản xuất của sản phẩm vi phạm. Trường hợp có lỗi tương tự như lô sản phẩm vi phạm nêu trên, công ty phải khẩn trương thông báo thu hồi đến các cơ sở phân phối, sử dụng và gửi báo cáo việc rà soát, thu hồi sản phẩm về Cục Quản lý Dược trước ngày 14/8/2025. Công ty chịu hoàn toàn trách nhiệm trước pháp luật nếu báo cáo không trung thực.
Ngoài ra, Sở Y tế thành phố Hà Nội, Sở Y tế tỉnh Hưng Yên phải giám sát Công ty cổ phần tập đoàn dược phẩm Starmed, Công ty cổ phần dược phẩm công nghệ cao Starmed trong việc thực hiện thu hồi, tiêu hủy lô sản phẩm không đáp ứng quy định.
Thu hồi số tiếp nhận phiếu công bố sản phẩm mỹ phẩm 52/22/CBMP-HY theo quy định tại điểm b, d khoản 1 Điều 46 Thông tư số 06/2011/TT-BYT. Kiểm tra Công ty cổ phần tập đoàn dược phẩm Starmed, Công ty cổ phần dược phẩm công nghệ cao Starmed trong việc chấp hành các quy định của pháp luật về quản lý mỹ phẩm trong hoạt động sản xuất, kinh doanh mỹ phẩm.
Xử lý, xử phạt vi phạm theo quy định hiện hành và báo cáo kết quả kiểm tra, giám sát về Cục Quản lý Dược trước ngày 14/9/2025.